
医疗器械咨询据广东省食品药品监督管理局2017年6月26日发布《 106-018 广东省第二类医疗器械优先审批申请》的办事指南如下:
一、办理要素
(一)事项名称和编码:广东省第二类医疗器械优先审批申请
(二)受理范围
1.申请人:广东省境内持有合法证照企业
2.申请内容:广东省第二类医疗器械注册优先审批申请
3.申请条件:
a.企业注册地在广东省内;
b.符合粤食药监办许〔2016〕579号文中第二条要求,且能提供粤食药监办许〔2016〕579号文中第三条材料的。
(三)受理地点
地址:广州市东风东路753号之二1楼受理大厅;交通指引:附近公交站:东峻广场站、动物园南门站;附近地铁站:杨箕站、动物园站;
地图:

(四)办理依据
关于印发《广东省第二类医疗器械优先审批程序(试行)》的通知粤食药监办许〔2016〕579号第三条 对于符合本程序第二条第(一)、(二)、(三)、(四)、(五)、(六)项情形的,医疗器械产品注册证申请人提交优先审批申请表,还应符合以下之一:
(1)临床急需且在本省尚无同品种产品获准注册的医疗器械,或虽在省内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要;
(2)诊断或治疗罕见病、恶性肿瘤,且具有明显临床优势的医疗器械;
(3)诊断或治疗老年人、儿童特有和多发疾病,且目前尚无有效诊断或治疗手段的医疗器械;
(4)列入国家、广东省科技重大专项或国家、广东省重点研发计划的医疗器械;
(5)广东省战略性新兴产业骨干企业、广东省直通车服务重点企业等广东省重点扶持的医疗器械生产企业申请医疗器械产品注册注册的;
(6)上一年度被省局评为质量信用A类,且本年度不在生产整改或涉案处理期间,未有医疗器械质量公告不合格的医疗器械生产企业;
(7)其他应当优先审批的医疗器械。
(五)实施机关
1.实施机关的名称:广东省食品药品监督管理局
2.实施机关的权限:广东省第二类医疗器械优先审批认定
3.实施机关的类别:行政机关
(六)办件类型:
出具认定意见
(七)出具意见条件
一)予以出具意见的条件:
(1)申报产品为第二类医疗器械,医疗器械注册证申请人属于我省辖区,申报产品拟由申请人生产且为首次注册。
(2)符合以下条件之一:
1.临床急需且在本省尚无同品种产品获准注册的医疗器械,或虽在省内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要;
2.诊断或治疗罕见病、恶性肿瘤,且具有明显临床优势的医疗器械;
3.诊断或治疗老年人、儿童特有和多发疾病,且目前尚无有效诊断或治疗手段的医疗器械;
4.列入国家、广东省科技重大专项或国家、广东省重点研发计划的医疗器械;
5.广东省战略性新兴产业骨干企业、广东省直通车服务重点企业等广东省重点扶持的医疗器械生产企业申请注册的医疗器械;
6.上一年度被省局评为质量信用A类,且本年度不在生产整改或涉案处理期间,未有医疗器械质量公告不合格的医疗器械生产企业;
7.其他应当优先审批的医疗器械。
( 二)医疗器械注册代办医疗器械优先审批不予出具意见的情形:
不符合以下条件之一的,不予出具意见:
(1)医疗器械注册申报产品为第二类医疗器械,申请人属于我省辖区,申报产品拟由申请人生产且为首次注册。
(2)符合以下条件之一:
1.临床急需且在本省尚无同品种产品获准注册的医疗器械,或虽在省内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要;
2.诊断或治疗罕见病、恶性肿瘤,且具有明显临床优势的医疗器械;
3.诊断或治疗老年人、儿童特有和多发疾病,且目前尚无有效诊断或治疗手段的医疗器械;
4.列入国家、广东省科技重大专项或国家、广东省重点研发计划的医疗器械;
5.广东省战略性新兴产业骨干企业、广东省直通车服务重点企业等广东省重点扶持的医疗器械生产企业申请注册的医疗器械;
6.上一年度被省局评为质量信用A类,且本年度不在生产整改或涉案处理期间,未有医疗器械质量公告不合格的医疗器械生产企业;
7.医疗器械注册证代办 医疗器械优先审批其他应当优先审批的医疗器械。
三)出具意见数量限制:无限制。
(八)申请材料
—)申请材料目录
(1)广东省第二类医疗器械优先审批申请表
简述优先审批理由,明确产品适用于《广东省第二类医疗器械优先审批程序》第二条中规定的何种情形。
(2)医疗器械注册申请表复印件(如有)
(3)符合《广东省第二类医疗器械优先审批程序》第二条情形的,分别按以下要求提供资料:
1.临床急需且在本省尚无同品种产品获准注册的医疗器械。
a.该产品适应证的临床治疗现状综述,说明临床急需的理由;
b.该产品和同类产品在省外批准和临床使用情况;
c.提供检索情况说明,证明目前省内无相关同品种产品获准注册,且目前尚无同等替代诊断或治疗方法。
2.省内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要。
a.简述当前突发公共卫生事件起因及进展,以及应急处置所需的医疗器械品种;
b.省内同类产品生产企业名单;
c.本企业获证后的预计产能。
3.诊断或治疗罕见病、恶性肿瘤,且具有明显临床优势的医疗器械。
a.该产品适应证的发病率数据及相关支持性资料;
b.证明该适应证属于罕见病或恶性肿瘤的支持性资料;
c.该适应证的临床治疗现状综述;
d.该产品较现有产品或治疗手段具有明显临床优势说明及相关支持性资料。
4.诊断或治疗老年人、儿童特有和多发疾病,且目前尚无有效诊断或治疗手段的医疗器械。
a.该产品适应证属于老年人、儿童特有和多发疾病的支持性资料;
b.该适应证的临床治疗现状综述;
c.目前尚无有效诊断或治疗手段的说明及相关支持性资料。
5.列入国家、广东省科技重大专项或国家、广东省重点研发计划的医疗器械。
a.该产品属列入国家、广东省科技重大专项或国家、广东省重点研发计划的医疗器械的说明;
b.相关支持性材料,如项目任务书等。
6.广东省战略性新兴产业骨干企业、广东省直通车服务重点企业等广东省重点扶持的医疗器械生产企业申请注册的医疗器械。
a.省经济和信息化委员会公布的广东省战略性新兴产业骨干企业或广东省直通车服务重点企业的通知和名单;(可提供网页版)
b.或省政府及其工作部门要求重点扶持的通知、批复。
7.上一年度被省局评为质量信用A类,且本年度不在生产整改或涉案处理期间,未有医疗器械质量公告不合格的医疗器械生产企业。
a.省食品药品监督管理局公布的上一年度质量信用A类生产企业的通知和名单;(可提供网页版)
b.企业本年度不在生产整改或涉案处理期间的自我承诺;
c.企业未有医疗器械质量公告不合格情形的自我承诺。
(4)所提交资料真实性的自我保证声明
二)医疗器械产品注册证代办 广东省第二类医疗器械优先审批申请材料要求
(1)申报资料应按本指南载明序号排列装订成册。
(2)应有所提交资料目录,包括申报资料的一级和二级标题。每项二级标题对应的资料应单独编制页码。
(3)申报资料应由申请人逐页签章。“签章”是指:企业盖章,或其法定代表人、负责人签名加企业盖章。
(4)医疗器械注册证代理由申请人编写的文件按A4规格纸张打印,字体大小适于阅读。
(5)申报资料使用复印件的,复印件应当清晰并与原件一致。彩色图片、图表应提供彩色副件。
(6)申报资料应当使用中文。原文为外文的,应当有中文译本。
3.申请表格及文件下载
广东省第二类医疗器械优先审批申请表
(九)办理时限
(1)医疗器械产品注册证代理医疗器械优先审批申请时限:无
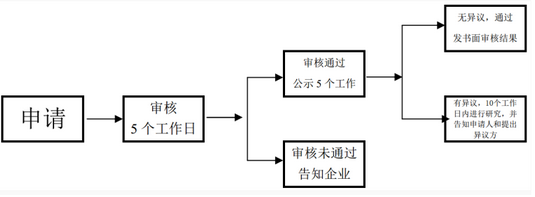
(2)法定办理时限:《广东省第二类医疗器械优先审批程序(试行)》 第五条 对于本程序第二条第(四)、(五)、(六)项情形的医疗器械优先审批申请,省局自收到申请之日起5个工作日内进行审核,符合优先审批情形的,拟定予以优先审批。对于本程序第二条第(一)、(二)、(三)项情形的医疗器械优先审批申请以及其他应当优先审批的医疗器械,省局组织专家论证审核,出具审核意见。经专家论证需要优先审批的,拟定予以优先审批。 第六条 省局将拟定优先审批项目的申请人、产品名称、受理号在其网站上予以公示,公示时间应当不少于5个工作日。公示期内无异议的,即优先进入审评程序,由省局书面通知申请人审核结果。
(3)医疗器械产品注册代理 医疗器械优先审批申请承诺办理时限:《广东省第二类医疗器械优先审批程序(试行)》 第五条 对于本程序第二条第(四)、(五)、(六)项情形的医疗器械优先审批申请,省局自收到申请之日起5个工作日内进行审核,符合优先审批情形的,拟定予以优先审批。对于本程序第二条第(一)、(二)、(三)项情形的医疗器械优先审批申请以及其他应当优先审批的医疗器械,省局组织专家论证审核,出具审核意见。经专家论证需要优先审批的,拟定予以优先审批。 第六条 省局将拟定优先审批项目的申请人、产品名称、受理号在其网站上予以公示,公示时间应当不少于5个工作日。公示期内无异议的,即优先进入审评程序,由省局书面通知申请人审核结果。
(十)医疗器械注册代理医疗器械优先审批申请收费情况:不收费。
(十一)申请人权利和义务
1.申请人依法享有以下权利:
(1)对于优先审批的项目,按照接收时间单独排序,优先办理,技术审查、检验时限分别在法定要求缩减20%以上,行政审批时限在法定要求缩减40%以上。
(2)对于优先审批的项目,省局审评认证中心在技术审评过程中,应当按照相关规定积极与申请人进行沟通交流,必要时,可以安排专项交流。
2.申请人依法履行以下义务:
(1)申请人应按照程序提交申请材料。
(2)申请人应对其申请材料实质内容的真实性负责。
三、医疗器械产品注册代办理流程图
鸿远医疗器械咨询公司 http://www.yixiezixun.com是一家技术专业的医疗器械产品注册证代办理咨询,医疗器械生产许可证代办,医疗器械经营许可证代办,一类医疗器械产品备案代办,二类医疗器械经营备案,CE认证,ISO13485认证,FDA注册,FDA认证,临床试验,医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册,出口证,自由销售证办理,临床试验及免临床资料编写,产品技术要求制订,技术文件编写辅导等提供一站式服务机构,欢迎您咨询与合作!

 在线客服
在线客服