
一次性使用手术衣医疗器械产品注册技术审查指导原则编写说明:
一、指导原则编写的原则
(一)本指导原则编写的目的是用于指导和规范第二类手术衣产品注册申报过程中审查人员对注册材料的技术审评。
(二)本指导原则旨在让初次接触该类产品的注册审查人员对产品结构、主要性能、预期用途等各个方面有个基本了解,同时让技术审查人员在医疗器械产品注册技术审评时把握基本的尺度,对产品安全性、有效性作出系统评价。
二、指导原则编写的依据
(一)《医疗器械监督管理条例》
(二)《医疗器械注册管理办法》(局令第16号)
(三)《医疗器械说明书、标签和包装标识管理规定》(局令第10号)
(四)《医疗器械标准管理办法》(局令第31号)
(五) 关于印发《境内第一类医疗器械注册审批操作规范(试行)》和《境内第二类医疗器械产品注册审批操作规范(试行)》的通知(国食药监械[2005]73号)
(六) 国家食品药品监督管理局发布的其他规范性文件
(七) 现行的国家标准和行业标准
三、指导原则的编写格式
指导原则正文的层次和目录遵从国家食品药品监督管理局的统一要求,语言表述采取提示方式,以利于审评人员直入审查内容。
四、指导原则中部分具体内容的编写考虑
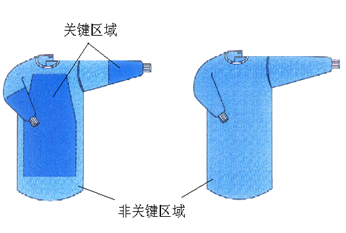
(一)产品的主要技术指标制定主要参考行业标准YY0506-2009《病人、医护人员和器械用手术单、手术衣和洁净服》。
(二)产品的预期用途是根据YY0506-2009《病人、医护人员和器械用手术单、手术衣和洁净服》提出的。为方便审评人员在确定预期用途时更具可操作性,经征求YY0506系列标准编写专家意见,本指导原则分别给出了高性能和标准性手术衣的具体预期用途,供审评人员参考使用。
(三)考虑到本指导原则规定的手术衣为一次性使用医疗器械产品,并结合目前国内该产品生产企业现状,参考相关专家意见,所以本指导原则规定的一次性使用手术衣应以无菌方式供应。
(四)因为一次性使用手术衣产品工艺成熟,临床应用多年,通过征求医疗器械检验专家、临床专家及部分省市医疗器械技术审评人员意见,认为通过非临床评价、注册检验及质量体系考核能够保证产品的安全性、有效性,所以本指导原则规定该产品原则上不要求进行临床试验。
五、指导原则编写人员
本医疗器械注册指导原则的编写成员由河南省医疗器械行政审批人员、注册技术审评人员、医疗器械检验、临床专家及相关企业技术人员共同组成。以充分利用各方面的信息和资源,综合考虑指导原则中各个方面的内容,尽量保证指导原则正确、全面、实用。
深圳鸿远医疗器械咨询服务公司 http://www.yixiezixun.com是一家技术专业的医疗器械产品注册证代办理咨询,医疗器械生产许可证代办,医疗器械经营许可证代办,一类医疗器械产品备案代办,二类医疗器械经营备案,CE认证,ISO13485认证,FDA注册/认证,临床试验,医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册,出口证,自由销售证办理,临床试验及免临床资料编写,产品技术要求制订,技术文件编写辅导等提供一站式服务机构,欢迎您咨询与合作!

 在线客服
在线客服