
医疗器械注册代办如何编写医疗器械远程监测系统注册产品说明书和标签样稿?医疗器械远程监测系统注册产品说明书和标签需要符合《医疗器械说明书和标签管理规定》以及相关国家标准、行业标准的要求。
1.产品型号规格、产品配置
产品说明书需要包含申报产品注册单元内所有型号规格/配置。
2.产品适用范围与禁忌证
产品适用范围。需要明确产品预期用途,规定操作人员需要具备的技能、知识和培训要求。
预期使用环境。使用环境要求一般包括温度、湿度、海拔大气压。
产品安装和调试。需要说明使用场景下的产品配置、系统布局、电源类型、服务器配置、通电试验及性能调试等必要内容,提供安装示意图。
适用人群。说明产品的适用人群。
禁忌证。若适用,应提供必要说明。
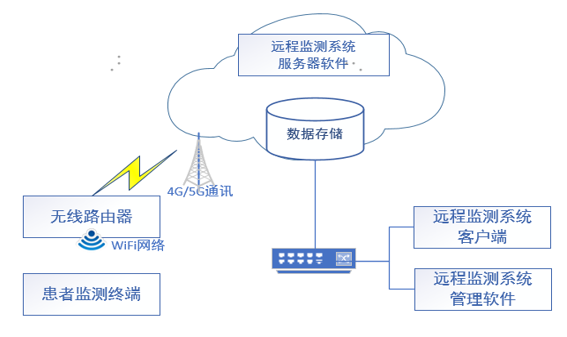
3.性能指标和技术参数
提供符合相关标准的产品技术参数,包括产品技术要求规定的性能指标。例如:产品符合YY 9706.102或YY 0505的EMC信息,包括:指南和制造商声明-电磁辐射、指南和制造商声明-电磁抗干扰、EMC测试电缆信息、基本性能信息等。
若适用,参考国际标准制定产品性能指标和技术参数的情形,需要说明引用相关标准的充分理由。
通讯设备:如果远程监测系统申报的产品结构组成中未包含通讯模块,则需外接网络通讯设备才能进行远程传输。需说明可以连接何种网络通讯设备,如无线路由器的规格要求,带宽要求,路由器的使用环境,路由器和互联网的连接方式等。
网络要求:对于网络接口,需考虑如下特征,包括但不限于网络类型(如广域网、局域网、个域网)、接口形式(如电口、光口)、数据接口(此时即数据协议,含标准协议、私有协议)、远程访问与控制方式(实时、非实时)、性能指标(如端口、传输速率、带宽)等。
产品本身可以读取机械故障的,通过软件的异常推送到用户;对于不能读到机械故障的,应在软件说明书中说明,比如说明该机械故障在该软件中当作非机械故障处理,及其处理方式。非机械故障造成的影响软件服务无法提供乃至无法运行的,说明书需进行提示。
产品接口和联合使用医疗器械。建议说明与申报产品联合使用的医疗器械的型号和制造商,规范接口要求,以及联合使用的注意事项。若需要医务人员进行连接,建议详述连接方法。建议说明申报产品连接的医疗器械、连接构成的系统需要符合的相关标准,以及其他必要信息。
4.注意事项、警告以及提示
提供远程监测系统操作相关的必要信息,产品说明书中一般以“危险”、“警告”和“注意”的形式出现。
5.推荐的清洁和消毒方法
说明需要清洁和消毒的产品部件。产品清洁和消毒的要求,需要符合远程监测系统的临床实际使用情况。
6.使用期限
注明产品使用期限。
7.产品日常维护和质量控制
提供整机质量控制的维护周期和质量检验方法,以及相关标准。
8.其他
若产品说明书中包含了本次申报注册单元之外、或不在中国申报的产品型号、规格、配置等相关内容,可以出具不在本次申报范围内的声明:
进口医疗器械若涉及上述情况,可以在说明书中删除相关内容,或在相关内容章节注明不申报的字样,或出具单独附页注明不申报、不适用的事项。
境内医疗器械若涉及上述情况,可以在说明书中删除不在中国申报的相关产品信息。
医疗器械远程监测系统注册代办产品说明书和标签样稿编写鸿远医疗器械咨询提供专业的咨询辅导。

 在线客服
在线客服