
办理医疗器械产品注册证申报怎么确定产品分类?请看下面详解内容:
一、医疗器械分类
在我国,医疗器械按照风险程度分为三类。
第一类风险程度低,实行常规管理可以保证其安全、有效的医疗器械。仅需医疗器械备案管理。
第二类具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。需要申报医疗器械产品注册。
第三类具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。需要申报医疗器械产品注册。
二、医疗器械类别的判定途径
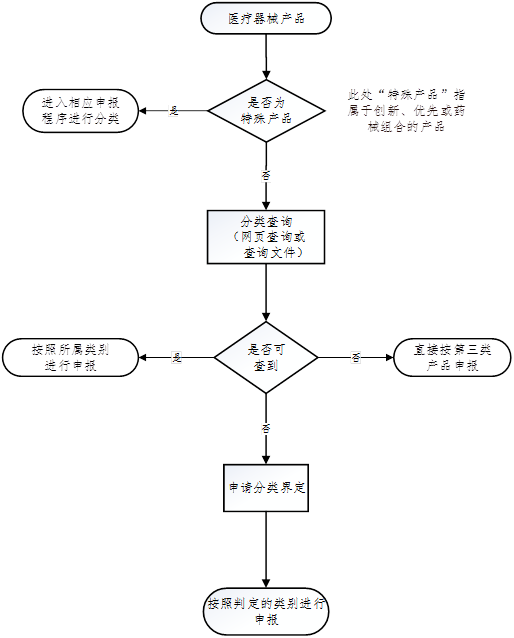
1. 网页查询分类目录
进入"国家药监局网站—医疗器械"栏——点击医疗器械查询——点击医疗器械分类目录。
2. 查询文件下载《医疗器械分类规则》《医疗器械分类目录》《体外诊断试剂分类规则》《体外诊断试剂分类子目录(2013版)》《第一类医疗器械产品目录》或搜索相关分类界定文件等进行查询。
3. 申请分类界定
未列入医疗器械分类目录里的境内产品向当地省局提交申请,进口产品向医疗器械标准管理研究所提交申请。具体可参照《医疗器械分类界定申请资料填报指南》。
4. 同第三类申报
可直接按第三类医疗器械产品申报,器审中心根据申报产品的实际情况判定类别。
5. 创新,优先,药械组合
属于创新、优先或药械组合的产品在办理进入相应流程后,可随即进行产品类别判定。
可参考如下流程:
三、《医疗器械分类目录》相关文件汇总
新版《医疗器械分类目录》自2018年8月1日开始实施,请根据相关要求进行分类工作。
国家药监局关于发布医疗器械分类目录动态调整工作程序的公告(2021年第60号)
国家药监局关于医用透明质酸钠产品管理类别的公告(2022年第103号)
医疗器械分类界定申请资料填报指南
医疗器械分类规则(国家食品药品监督管理总局令第15号)
体外诊断试剂分类规则(2021年第129号)
总局关于发布医疗器械分类目录的公告(2017年第104号)
食品药品监管总局关于印发体外诊断试剂分类子目录的通知(食药监械管〔2013〕242号)
国家药监局关于发布第一类医疗器械产品目录的公告(2021年第158号)
关于调整《6840体外诊断试剂分类子目录(2013版)》部分内容的公告(2020年 第112号)
国家药监局关于药械组合产品注册有关事宜的通告(2021年第52号)
总局办公厅关于规范医疗器械产品分类有关工作的通知(食药监办械管〔2017〕127号)
总局关于实施《医疗器械分类目录》有关事项的通告(2017年第143号)
总局关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(2017年第226号)
国家药监局关于实施《第一类医疗器械产品目录》有关事项的通告(2021年第107号)
《医疗器械分类目录》实施有关问题解读
《体外诊断试剂分类规则》解读
《关于药械组合产品注册有关事宜的通告》(2021年第52号)解读
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2020年 第147号)
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第25号)
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、广西、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、体外诊断试剂注册、进口医疗器械注册、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立( ISO13485, GMP, CE,QSR820,CMDCAS);注册、医疗器械出口销售证明、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、医疗器械广告批文申报、电磁兼容整改等提供一站式服务公司,老师微信及手机号:13590396780欢迎您咨询与合作!

 在线客服
在线客服