
医疗器械注册证申请电动气压止血仪产品说明书、标签和包装标识的编写应符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号、YY/T 0466.1-2009 《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》、GB 9706.1-2007《医用电气设备 第1部分:安全通用要求》及YY 0505-2012《医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验》等相关标准的规定。
医疗器械产品注册证申请说明书、标签的内容应当真实、完整、科学,并与产品特性相一致,文字内容必须使用中文,可以附加其他语种。中文的使用应当符合国家通用的语言文字规范并注意知识产权。说明书、标签、包装标识中的文字、符号、图形、表格、数字、图片等应相互一致,并符合相关标准和规范要求。
1.最小销售单元标签要求
(1)应具有产品名称、型号规格。产品名称应符合本指导原则中产品名称的要求。
(2)应有注册人的名称、住所、联系方式。
(3)应有生产申请人的名称、住所、生产地址、联系方式及生产许可证编号;委托生产的还应当标注受托申请人的名称、住所、生产地址、生产许可证编号。
(4)应有医疗器械注册证编号及产品技术要求编号。
(5)应有生产日期,使用期限。
因位置或者大小受限,未能对标签进行完整标注时,应在标签中明确“其他内容详见说明书”。
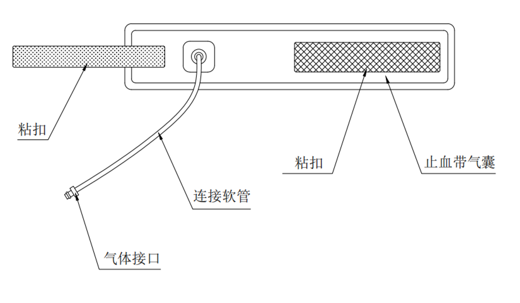
2.气压止血带包装(至少应包括以下信息)
2.1 对于配套或销售给用户的气压止血带,外包装上至少应包括:规格和尺寸,使用的方法和适用的肢体周长。
2.2 灭菌的方式或标识(若适用)。
2.3 使用后的处理及回收方法。
3.医疗器械注册证代办产品说明书要求
每台设备都应附带说明书,内容框架至少包含《医疗器械说明书和标签管理规定》中第十条中规定的有关要求。同时,说明书应符合GB9706.1和YY 0505的要求,至少应包括以下内容:
(1)输入电压和频率、输入功率、正常工作和贮存条件。
(2)包括电磁兼容性的相关描述,例如:周围环境中超出YY0505标准要求的电磁干扰可能会影响产品正常工作。
(3)配套或适用的气压止血带型号/规格和种类。
(4)内部充电电池型号/规格(若适用)及更换方法。
(5)说明书中应包括对使用警告总结的章节。
(6)介绍如何拆包、安装、进行使用前检查,获取帮助服务的渠道、标准操作程序、常规维护、再校准及清洗频次建议。
(7)提供操作程序、简图和零件列表,以及如何联系申请人。
(8)提示按照厂家指定的时间间隔对电动气压止血仪的压力传感器/指示器的精度进行校验。
(9)详细的使用方法,至少包括:正确和适合的气压止血带尺寸的选择,并声明应由临床专业人士决定电动气压止血仪的压力数值设定。
(10)提示用户,电动气压止血仪产品禁忌症。
(11)声明如果在申请人指定的温度和湿度范围外储存或使用,系统可能无法达到声称的性能(申请人指定的温度和湿度范围应一并在声明中给出)。
(12)产品是否适用新生儿,若适用,则应提供适用的信息。
(13)当气压止血带在持久过分充气时状态下可能存在的风险。
(14)确定显示装置故障的方法。
(15)推荐使用的消毒和灭菌程序。
(16)若产品需要与衬垫、保护套等附件配套使用,请说明对配套附件的要求以及如何配合使用的操作方法。
(17)应在显著位置标示,止血压力设定应以能够达到止血目的的最小值为宜。
4. 医疗器械产品注册证代办部件标识
(1)部件更换,如果某些部件可由使用者更换,而更换后可能会影响设备的性能以至于不再符合要求,则该产品部件的标识应有如下措词的陈述“注意:如果以非厂家提供的部件更换原有部件可能会引起测量错误”。
(2)电源系统标识(工作电压、工作电流及工作频率)。
(3)电池供电设备的标识。
(4)气压止血带标识。气压止血带上应标示或说明尺寸或其适用的肢体周长的范围。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、体外诊断试剂注册、进口医疗器械注册、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立( ISO13485, GMP, CE,QSR820,CMDCAS);注册、医疗器械出口销售证明、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、医疗器械广告批文申报、电磁兼容整改等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服