
医疗器械注册咨询据东省药监局2020年4月4日发布《广东省药品监督管理局关于已应急备案产品申请开展应急审批的办理指引》
根据《广东省药品监督管理局关于调整医用口罩等疫情防控产品应急审批工作的通告》(2020年 第32号)要求,对已取得一次性使用医用口罩、医用外科口罩、医用防护口罩、医用防护服、红外体温计等5类产品应急备案凭证的,向我局提出开展应急审批的办理指引如下:
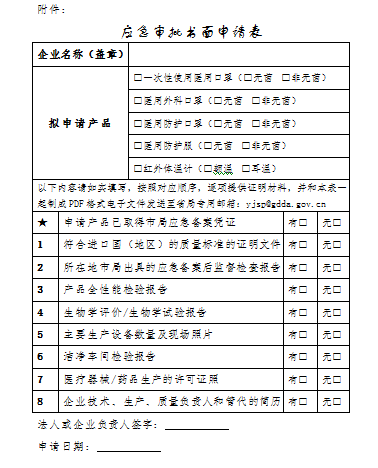
一、申请人填写应急审批书面申请表(见附件),将表格及证明材料制成PDF格式电子文件发送至省局专用邮箱:yjsp@gdda.gov.cn,邮件名注明“企业名称+产品名称+应急审批”。申请人在1个工作日内未收到确认邮件,请广东省局受理大厅咨询。
二、经我局组织评估后,纳入应急审批程序的,将通过上述专用邮箱以电子邮件告知。企业收到告知邮件后,应于3个工作日内提出应急审批申请;逾期未提交的,需按本办理指引重新申请开展应急审批。
三、申请人申报应急审批注册的,按照第二类医疗器械注册证核发办事指南,申报类型选择“优先审批”,同时上传省局应急审批告知邮件截图内容;产品名称填写时应使用括号备注“疫情应急产品”,如:医用防护口罩(疫情应急产品)。
四、申请人应在注册受理后2个工作日内提交注册质量管理体系核查申请,具体要求见办事指南
五、医疗器械注册申请人应建立质量管理体系并保持有效运行,配备相应生产设备、人员、场地,具备生产管理和质量控制能力,保留相应记录,具体参见原国家食品药品监管总局2014年发布的《医疗器械生产质量管理规范。审评部门自收到材料之日起在2个工作日内组织开展现场检查。检查后涉及整改的,申请人应在10个工作日内提交整改报告,逾期未提交的,应急注册申请予以退回办结。注册质量管理体系核查未通过的,应急注册申请不予批准。
六、审评部门在体系核查完成后3个工作日内完成技术审评。审评过程需要申请人补充资料的,应当15个工作日内补充。逾期未补充的,应急注册申请予以退回办结。审评部门在收到补充资料后3个工作日内完成最终技术审评。
七、审批部门在技术审评完成后3个工作日内完成行政审批。
八、申请人提出应急审批申请的,应提前做好申报前的准备,配合做好应急审批各环节办理,因申请人无法按要求履行的,退出应急审批程序,按优先审批程序开展。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、体外诊断试剂注册、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立( ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服