
医疗器械注册医用激光光纤的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化。注册申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需详细阐述其理由及相应的科学依
光导纤维(以下简称光纤)是一种多用途的光学元件,它具有传输光的作用。医用激光光纤是以光纤为传播介质, 通过传输激光而用于治疗、检查和诊断。按预期用途划分,一般分为两大类:①治疗用,②检查和诊断用。其中,治疗用激光光纤,是指将激光主机发射出的激光能量通过光纤传输至患处,利用激光能量进行治疗的产品。检查和诊断用激光光纤通常为检查和手术中所使用的用于显示光纤的位置或传输激光用于诊断(例如:荧光诊断、光谱诊断)的产品。按材料分,有玻璃光纤、塑料光纤、石英光纤和液芯光纤等;按折射率分布形式,有普通阶跃型和梯度折射率型;按使用波段,有可见光波段、红外波段和紫外波段的光纤;按光纤中传输的光的模式分,有单模光纤和多模光纤。
医疗器械产品注册激光光纤一般包括连接器(或称连接头)、光纤传输体、应用端
应用端按光纤末端是否需要进行特殊处理,分为普通应用端和特殊应用端。普通应用端以光纤传输体末端直接构成应用部件,光纤出光端为直射平切端面,也就是常说的“裸光纤”;特殊应用端是在光纤传输体末端上进行一定的处理来满足预期用途,包括但不限于连接其他外接部件构成应用部件,如手持件(手柄)、微控制器、微透镜等,对光纤传输体末端进行二次加工构成应用部件,从而改变光束的输出方式。
医疗器械注册办理医用激光光纤产品注册申报综述资料要求
(一)概述
在《关于发布医疗器械分类目录的公告》(国家食品药品监督管理总局公告2017年第104号)中,治疗用激光光纤的管理类别为二类,新的分类编码为01。眼科激光光纤中眼内激光光纤的管理类别为三类,其他为二类,新的分类编码为16。该目录于2018年8月1日起施行。
医疗器械注册代理产品名称应为通用名称,并符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)等相关法规、规范性文件的要求。核心词为“光纤”,特征词有“激光”、适用科室或病种、一次性使用等。例如:眼内激光光纤。若是一次性无菌产品,应在名称中明确。例如:一次性使用无菌激光光纤。
(二)产品描述
工作原理:应描述产品的工作原理,提供图示详细说明激光在光纤中的传播光路图、激光从光纤出射后的传播光路图及激光输出光斑的图片。
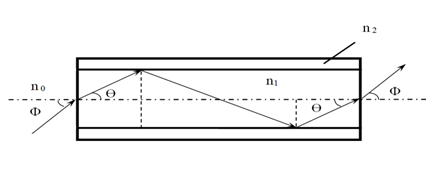
图4 激光在光纤中的传播光路图示例
光纤用于传输激光的基本原理是“光的全反射”,根据结构和材料的不同,或者根据不同的预期用途,产品的原理有一些具体的差异,申请人应在申报资料中明确。
医疗器械产品注册办理全反射,是指光由光密介质射到光疏介质的界面时,全部被反射回原介质的现象。光密介质即相对而言,光在此介质中折射率大;光疏介质是相对折射率小的部分。
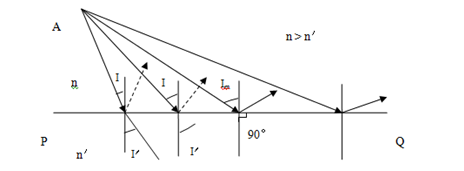
图4 全反射原理图
医疗器械注册代办结构组成:应详述连接器、光纤传输体、应用端的具体结构。明确纤芯、包层、涂覆层各自的材质,纤芯和光纤的直径,及各组件的物理尺寸。必要时,可配示意图。提供光纤应用端的清晰图片,并说明结构和材质。明确应用端结构形状,例如是否仅为纤芯,或含有其他结构。若外接应用端,还应详细说明外接应用端的形状及材质。明确激光主机连接器是否具有识别功能,例如射频识别(RFID)功能等,并说明其工作原理。说明光纤表面是否有标记以及标记的用途,例如是否射线、超声或其他影像设备可见。
(三)型号规格
明确型号规格及划分依据。对于有多种型号的情况,必要时,可列表和/或提供图示说明各型号之间的异同。
(四)包装说明
光纤的包装应该能够保护其免受不利的储存和运输条件影响所造成的损害。对于光纤类产品,主要是从光学元器件的保护角度出发,目的是保障其光学性能和机械性能。
若为无菌包装,还应提供一次性使用无菌包装与灭菌方法相适应的最初包装的信息。
(五)适用范围和禁忌症
医疗器械产品注册代理对于单独申报的通用型激光光纤,适用范围建议描述为:在医疗机构中使用,与输出波长为xxx nm的激光器配合使用,用于传输激光能量。若光纤有特定的预期用途,应在适用范围中明确,例如“用于静脉曲张的治疗”“用于结石的治疗”。除此之外,其他结合实际情况确定适用范围。
专用光纤建议与主机一同申报。若单独申报,适用范围中应明确激光主机的生产厂商及型号信息,建议描述为:在医疗机构中使用,与(生产厂商)xxx型号的输出波长为xxx nm的激光器配合使用,用于传输激光能量。
(六)参考的同类产品或前代产品信息
应提供同类或前代产品的基本信息和上市信息,同类产品应明确生产商,如是已在我国取得注册证产品,应明确注册证号。重点明确以下差异:工作原理、结构组成、主要技术参数、材料(特别是预期与人体接触部分的材料)、适用范围。其中主要技术参数对比应参照产品技术要求。
(七)其他需说明的内容
应说明与其他器械组合使用的方式、存在的物理电气连接方式。说明产品的照射方式,体表、血管内还是需通过内窥镜进入人体。
医疗器械产品注册代办专用型光纤应明确特定配合使用的设备信息,如产品名称、型号规格、生产商信息等。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服