
医疗器械注册《医疗器械分类目录》中使用液体试剂以紫外—可见光分光光度法对各种样品进行定量分析的生化分析仪,管理类代号为6840。
医疗器械生化分析仪产品名称的要求:
生化分析仪产品的命名应符合国家关于医疗器械命名规则的要求,采用《医疗器械分类目录》或国家标准、行业标准上的通用名称,一般分为半自动生化分析仪和全自动生化分析仪。命名原则如下:自动化程度+生化分析仪
医疗器械注册代办产品的结构和组成
半自动生化分析仪按吸收池型式可分为固定式或流动式;单色装置分为滤光片式、光栅式、固定发光器件或其他等效方式。组成一般包括光源、单色装置、吸收池、检测器、温控装置、显示装置和控制单元等。
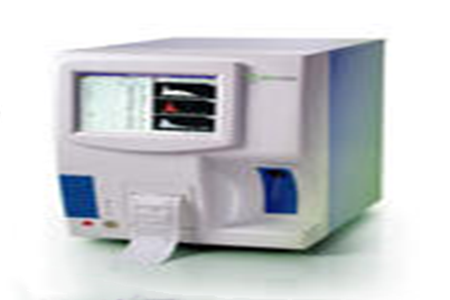
全自动生化分析仪的结构一般按吸收池的型式分为分立式或流动式;按单色装置分为滤光片式(干涉滤光片或吸收滤光片)、光栅式、固体发光器件或其他等效方式;按光路型式分为前分光或后分光;按比色容器类型分为循环使用式或一次性使用式。仪器组成一般由光电比色部分、进样系统、控制单元、数据处理系统、清洗系统等组成。产品图示举例:
医疗器械注册办理生化分析仪产品工作原理/作用机理
生化分析仪的设计理论依据:根据物质在紫外、可见光区产生的特征吸收光谱和朗伯比尔定律的原理,用未知浓度的样品与已知浓度标准物质比较或根据摩尔吸光系数方法进行定量分析。工作原理主要为以一束单色光/白光射入被检测液体,透过被测液体的光信号被检测后转换成电信号,对该信号进行适当转换及运算处理,参照标准曲线,从而可得到被测液体的浓度。
因该产品为非治疗类医疗器械,故本指导原则不包含产品作用机理的内容。
医疗器械产品注册单元划分的原则和实例
同一注册单元考虑的范围:对同一种吸收池类型、同一种单色装置、同一种光路形式、同一种比色容器类型,可考虑归入同一注册单元。
生化分析仪注册产品适用的相关标准:
医疗器械产品注册办理目前与生化分析仪产品相关的常用标准如下:
GB/T 191—2008包装储运图示标志
GB 4793.1—2007测量、控制和实验室用电气设备的安全要求 第1部分:通用要求
GB 4793.9—2007测量、控制和实验室用电气设备的安全要求 第9部分:实验室用分析和其他目的自动和半自动设备的特殊要求
GB 4943—2011信息技术设备 安全 第1部分:通用要求
GB/T 14710—2009医用电器环境要求及试验方法
YY/T 0014—2005半自动生化分析仪
YY/T 0316—2008医疗器械 风险管理对医疗器械的应用
GB/T 29791.3—2013体外诊断医疗器械 制造商提供的信息(标示)第3部分:专业用体外诊断仪器
YY 0648—2008测量、控制和实验室用电气设备的安全要求 第2-101部分:体外诊断(IVD)医用设备的专用要求
YY/T 0654—2008全自动生化分析仪
GB/T 18268.1—2010测量、控制和实验室用的电设备 电磁兼容性要求 第1部分:通用要求
GB/T 18268.26—2010测量、控制和实验室用的电设备 电磁兼容性要求 第26部分:特殊要求 体外诊断(IVD)医疗设备
上述医疗器械注册标准包括了产品技术要求中经常涉及到的标准。有的企业还会根据产品的特点引用一些行业外的标准和一些较为特殊的标准。
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写技术要求时与产品相关的国家、行业标准是否进行了引用,以及引用是否准确。可以通过对技术要求中是否引用了相关标准,以及所引用的标准是否适宜来进行审查。此时,应注意标准编号、标准名称是否完整规范,年代号是否有效。
医疗器械注册代理其次对引用标准的采纳情况进行审查。即所引用标准中的条款要求,是否在技术要求中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
医疗器械产品注册代理申请产品的适用范围/预期用途、禁忌症:
供定量分析血清、血浆、尿液、脑脊液等样本的临床化学成分。
该产品无禁忌症。
深圳鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册代理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服