
医疗器械咨询进口医疗器械是指从境外进口的医疗器械,进口的医疗器械需要在国内销售就得先申请进口医疗器械注册证,办理条件申请人应为境外生产企业,且该医疗器械已在注册申请人注册地或者生产地址所在国家(地区)已获准上市销售。
进口医疗器械注册办理企业资料准备清单如下:
公司概况
1. 公司简介;
2. 境外申请人注册地或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件、企业资格证明文件。
3. 境外申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括医疗器产品注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。(若在上市地是非医疗器械时,才需提供 )
4. 境外申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
办理进口医疗器械注册场地要求:
1. 公司平面图:包括(厂区、研发场地、生产场地、实验室、办公室,检验室);标明尺寸面积;
进口医疗器械注册产品基础资料和研究资料(重点):
1. 产品名称,规格型号及尺寸,规格型号的划分说明以及不同型号间的区别;
2. 产品工作原理、作用原理(如适用)、预期用途、治疗/诊断病种、适合人群、禁忌症;
3. 产品结构组成,关键部件及其功能;
4. 产品照片(所有规格型号的产品照片、部件的图片及其描述、包装的照片);
5. 主要原材料、外购件的清单(名称、型号、供应商,原材料材质证明);
6. 提供产品生产工艺流程图与生产作业指导书,注明关键工艺和特殊工艺,并说明其过程控制参数。
7. 产品风险分析管理报告;
8. 产品图纸、产品性能参数、性能确定参考的国际国内标准或规范性文件;(或技术要求)(如有);
9. 产品是否与患者接触,若接触,提供生物相容性评价研究资料、生物安全性研究资料(生物相容性报告);
10. 产品包装方式(包装层数、包装材料、包装规格、包装外观图),标签和包装的设计样稿;
11. 产品说明书; 医疗器械注册检验所需样品(数量:30pcs)。
12. 提供产品灭菌/消毒工艺及参数研究资料(包括验证与确认)、产品运输、储存研究资料,产品有效期和包装研究资料;
13. 与产品相关的信息(国内外已上市、同行或同类产品信息),以及与其他产品的对比资料(对比产品资料:产品说明书,技术要求,注册证,临床文献);
14. 与产品配套使用的设备情况;(若有配套使用)
15. 产品临床相关研究资料(如:临床实验报告,临床文献,临床数据研究)
备注:免临床注册:10个月,做临床注册:20个月。
医疗器械注册代理提醒大家:国外进口注册目前一般不需要体系核查。
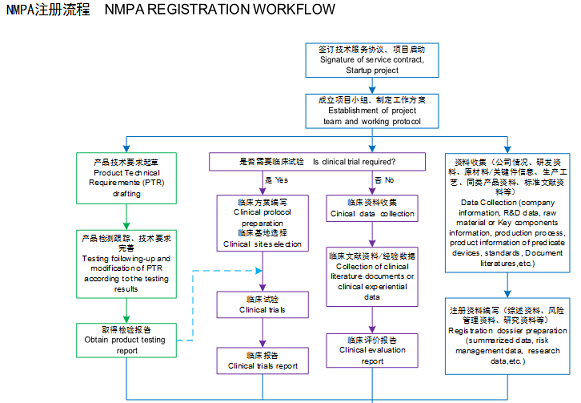
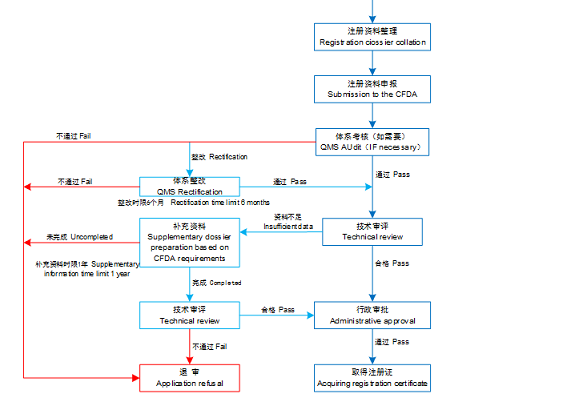
进口医疗器械注册流程:
深圳鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械注册代办理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服