
日本医疗器械产品注册审评审批机构PMDA简介:
一、PMDA 概述
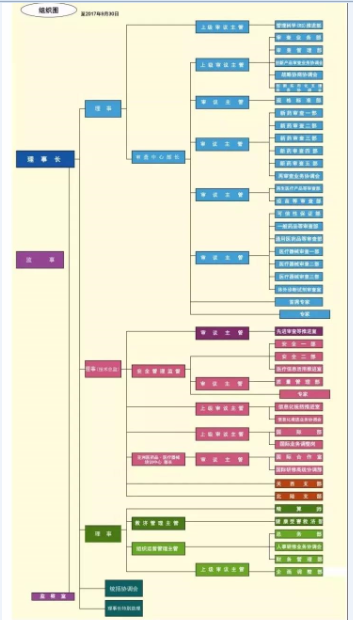
医疗器械咨询 据PMDA 全称 为Pharmaceuticals and Medical Devices Agency, 其日语名称翻译为“独立行政法人医药品医疗器械综合机构”, 是厚生劳动省医药食品局所管辖的独立行政法人。PMDA 的业务主要包括审查、安全对策、健康损害救济三大板块,截至2017 年 4 月 1 日的数据显示,审查、安全对策、健康损害救济业务分别有员工 578、190、39 名,其中 2014 年4 月公布的负责医疗器械审查人员数量为 104 名。PMDA 的组织机构图见图1,其中第一个理事及其分支为审查相关的业务部门。
图1 PMDA 组织机构图
二、PMDA 的主要业务
(一)审查
审查业务旨在管控风险、降低风险,是上市前对产品安全有效性的审核,审查业务包括临床试验和其他问题的咨询,对药品、医疗器械和再生医疗产品的合规性审查、再审查 / 再评价 , 针对按法规要求实施的试验的科学性、伦理性进行调查(GCP/GLP/GPSP 符合性评估), 生产过程和设施的 GMP/QMS/GCTP 检查 , 已注册认证机构的检查 , 标准的制修订等。
根据新版《药事法》,对初次获得批准的医疗器械,经一定时期后,要进行再审查。新设计的、结构新颖的或采用新原理的医疗器械,在获得初次批准后第四年,接受再审查。具有新效力、新用途或新性能的医疗器械产品,则在获得初次批准后第三年,接受再审查。
自 2015 年 10 月医疗器械审查部门实行新体制,由原来两个审查部调整为三个,分工见表 1。
医疗器械产品注册办理表 1医疗器械审查部门分工
|
审查 部门 |
领域 |
品种 |
|
一部
|
机器人、ICT(InformationandCommunicationTechnology信息和通信技术)及其他领域 |
机器人技术、先进的ICT技术等创新医疗器械、多科室医疗器械等 |
|
矫形、整形领域 |
人工关节、接骨用品、创伤包裹材料等 |
|
|
二部 |
精神、神经、呼吸、脑、血管领域 |
血管支架、人工呼吸系统等 |
|
消化、生殖系统领域 |
消化系统支架、胶囊内窥镜、透析设备、泌尿系统医疗器械、妇产科设备等 |
|
|
牙科口腔领域 |
牙科用植入体、龋齿治疗、补牙材料等 |
|
|
三部
|
眼科、耳鼻科领域 |
眼内镜、人工耳蜗等 |
|
心肺循环系统领域 |
辅助人工心脏、冠状动脉支架等 |
同时设有八个跨部门的小组,包括:
(1)临床评价小组;
(2)生物学安全小组;
(3)电气安全小组(含激光);
(4)软件小组(含网络安全应对);
(5)后发小组(包括合作计划:实质等同的明确化);
(6)国际应对小组,含IMDRF(International Medical Device RegulatorsForum,国际医疗器械监管者论坛);
(7)监管科学小组(监管科学案例策划、与监管科学推进部的协调,以及对非其他小组管辖的监管科学案件的应对);
(8)再生医疗制品审查部、生物源器械办公室(生物源制品的安全性评价)。
(二)安全对策
安全对策业务是指上市后的安全措施,旨在持续性降低风险,是PMDA 与厚生省一同协作,为了保证医疗器械的安全、放心使用而实施。PMDA 与厚生省从制造商、经销商、医疗机构等处收集与医疗器械产品质量、有效性、安全性相关的信息,并对收集的信息进行科学的调查、探讨,形成的安全对应策略。医疗器械注册代办根据各项规定要求,在 PMDA 官网上不仅可以查到审查相关的资料,同时可以查到紧急安全性信息、关于医疗安全信息的通知等。
(三)健康损害救济
健康损害救济旨在为医疗领域健康已受到的伤害采取救助措施,此业务与审评审批业务关系不大,因此本文未深入研究探讨。
三、PMDA 的承认审查
1. 新医疗器械:与已批准的医疗器械在结构组成、使用方法、效果及性能方面有明显差异的医疗器械。
2. 改良医疗器械:不属于新医疗器械或后发医疗器械的医疗器械。
3. 后发医疗器械:被认为与已批准的医疗器械在结构组成、使用方法、功能、效果及性能等有等同性的医疗器械,即与已批准医疗器械在构造、使用方法、效果及性能本质上等同的产品,申请认证或承认时不需要提供临床试验数据。
医疗器械注册代理新医疗器械与改良医疗器械一般无相应的审查标准,无论风险等级为Ⅱ、Ⅲ还是Ⅳ级,均由 PMDA 进行审评,厚生省承认。自 2009 年起,对于已有审查标准的后发医疗器械,可由第三方认证机构认证;无审查标准的后发医疗器械仍由 PMDA 审评,厚生省承认。根据 PMDA 公开的 2016 年度工作 报 告 中 的 数 据,2014~2016 年 度PMDA 审评的各类医疗器械数量见表 2。
表 2 PMDA2014~2016 年度承认的医疗器械数量
|
年度注1 / 类型 |
2014 年度 |
2015 年度 |
2016 年度 |
|
新医疗器械注2 |
67 (5) |
56 (8) |
26 (1) |
|
改良医疗器械注3 |
248 (35) |
293 (53) |
269 (44) |
|
后发医疗器械 |
917 |
868 |
825 |
注:1.日本的财政年度采取跨历年制,从当年4月1日至下年的3月31日止,例如2016年度指2016年4月1日至2017年3月31日;
2.括号中数字为优先品种数量;
3.括号中数字为开展临床试验的品种数量。
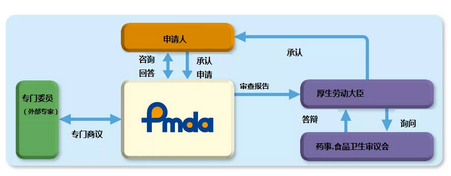
日本医疗器械注册获得承认的流程见图2:
深圳鸿远医疗器械咨询服务公司 http://www.yixiezixun.com是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械注册证代办理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服