
医疗器械注册证申请硬性光学内窥镜<有创类>注册证申请产品说明书和最小销售单元的标签样稿应符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)及相关法规要求,此外应符合GB 9706.1—2007、GB 9706.19—2000和YY 0068系列标准中对于此类产品说明书的要求。
说明书中的技术参数应与技术要求及检测报告一致。其中,对于产品安全、有效性相关的功能和参数应得到验证,并体现在技术要求中。
医疗器械产品注册证的说明书编写示例可参考YY 0068.3—2008中附录A随附资料的举例。
另外,对于进口产品注册,应提交原产国上市的产品说明书及标签和符合6号令的中文说明书和最小销售单元标签样稿。原则上,原产国上市所用说明书内容与中文说明书内容相比,除了适应我国法规及技术文件的差异之外,主要技术参数、结构等内容应保持一致。
对于含有多个型号产品的注册申报,应提交包含所有型号的说明书,说明书的产品名称、型号、结构组成、适用范围、生产商信息、代理人信息(如适用)、技术参数等信息均应与各项技术资料中一致。
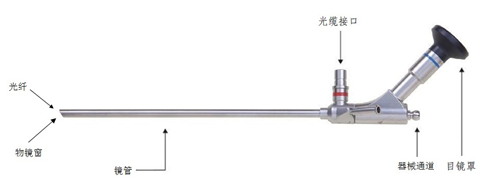
除了以上的基本要求之外,硬性光学内窥镜由于产品的特性,有一些需要关注的内容,下面给出一些例子供参考。
对于硬性光学内窥镜产品来说,内窥镜的清洗、消毒、灭菌部分是随附资料中非常重要的,必不可少的部分。应详细写明采用的方式、使用的工具/设备,操作流程和注意事项。另外,常规的维护保养方法以及有效期限的确定也是需要明确的信息。内窥镜类产品通常涉及使用前的检查,用以保证使用的效果,相关的说明也应在随附资料中有所体现。例如:每次使用前必须对内窥镜进行检查:锋利的边缘凹痕或划痕、裂纹、弯折、锈蚀、变形、镜头或镜头盖破损、标记/标签清晰可见、缺失部件。
医疗器械产品注册证代办硬性光学内窥镜通常由医用冷光源提供照明光,经由光缆传递到内窥镜头端出射,虽然光源本身的光能转换成热量的比率较小,但是由于头端光线比较集中,长时间的照射存在灼伤人体组织的危害。因此,在说明书中应有警示。
例如:光学镜在接通光源时,光缆入口处和进入人体部头端处的温度可能超过41℃,容易灼伤患者和引起手术室火灾。为了降低这些风险,应注意以下几点:
1.不要让内窥镜直接接触患者组织或易燃材料,例如铺巾或纱布。
2.每次开始手术时,将光源调节至最低设置。根据需要逐渐增加光输出,直到光照达到最低足够水平。
3.尽量不要长时间照射同一位置,如必要,请关注被照区域温度。
4.在断开光缆或接头前,请先关闭光源并让内窥镜冷却。
另外,是否能与激光或者高频设备互连使用需要在说明书中明确说明或者给出警示。如可以联用,产品相关的激光方面的防护措施及高频的互联条件都应满足,从而防控此方面的风险。如不能联用而在实际中使用,有对医生及患者产生伤害的可能性,需要重视。
医疗器械注册证代理内窥镜是光学产品,使用中离不开光线,光在提供照明的同时,在某种条件下有对人眼产生伤害的可能性。因此,此类型的设备在使用中应有警示,例如:不能直视出光口;连接好设备后再打开光源,关闭光源后再断开连接;以最小输出打开光源,光源调暗后再关闭等。
来源于:鸿远医疗器械咨询 http://www.yixiezixun.com

 在线客服
在线客服