
医疗器械产品注册医用低温保存箱技术要求编写应注意的事项:
医用低温保存箱产品技术要求应包括的主要性能指标根据《医用低温保存箱注册技术审查指导原则》对产品的主要性能指标的审查,可以通过对检验报告内容的审查来评价是否达到了要求,检验报告的内容是否齐全又可以通过对产品技术要求的内容是否齐全来进行审查。因此医疗器械注册产品技术要求的审查是产品主要技术性能指标审查中最重要的环节之一。
可以通过是否具有以下主要内容来进行审评。
1.规格型号
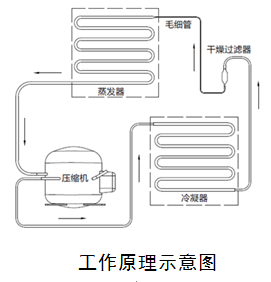
医用低温保存箱可按预期用途、结构组成、总有效容积、特性点温度等分为不同规格型号,可参照GB/T 20154—2014的规定,如:DW—86L370表示—86℃、立式、总有效容积为370L的低温保存箱。
2.软件信息
需对软件名称、型号规格、发布版本、完整版本命名规则作出规定。
3.一般性能
医疗器械注册代办应符合GB/T 20154—2014的技术要求。
应对附件制定相应要求,如容器、搁架、需用人工取出的盛物盘、温度传感器等。
软件功能应符合说明书及软件描述文档中的功能描述。
若产品具有用以进行电子数据交换或远程监测的网络连接功能,应制定相应要求。
超出本指导原则温度范围的医用低温保存箱可参考上述条款制定性能要求。
4.安全性能
医疗器械产品注册代办应符合GB 4793.1—2007的要求,并以附录形式列明医用实验室用电气设备基本安全特征(无需编写详细的电气安全附录)。如需编写详细的电气安全附录,建议注明适用项目及不适用项目理由。
5.电磁兼容
应符合GB/T 18268.1—2010的要求。
6.环境试验
应符合医疗器械产品注册GB/T 14710—2009的要求。
应逐项审查上述要求和检验结果是否符合规定。
鸿远医疗器械咨询服务公司是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册代理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服