
2017年广东省医疗器械注册审评审批基本情况
1、受理情况
2017年广东省局共受理了医疗器械产品注册申请3405项,同比减少了30.98%。其中,医疗器械(有源和无源类)2438项,同比减少了16.73%,首次注册636项,延续注册554项,许可事项变更注册364项,登记事项变更注册884项;体外诊断试剂967项,同比减少了51.78%,首次注册160项,延续注册216项,许可事项变更注册206项,登记事项变更注册385项。表4 2016年和2017年广东省医疗器械产品注册申请受理情况
| 年份 |
受理总量 (项) |
首次注册 (项) |
延续注册 (项) |
登记事项变更注册(项) | 许可事项变更注册(项) |
| 2016年 | 4933 | 1808 | 942 | 1202 | 981 |
| 2017年 | 3405 | 796 | 770 | 1269 | 570 |
| 同比 | -30.98% | -55.97% | -18.26% | 5.57% | -41.90% |
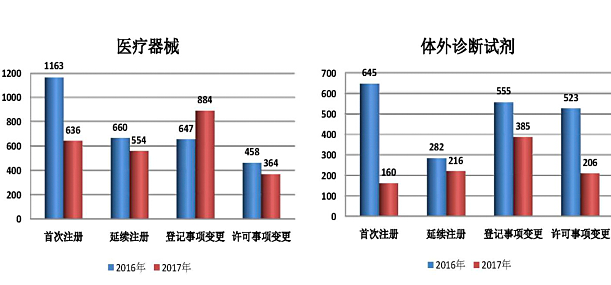
 图5 2016年和2017年广东省医疗器械产品注册申请受理情况
图5 2016年和2017年广东省医疗器械产品注册申请受理情况
医疗器械注册代办根据《省发改委、省财政厅关于我省药品医疗器械产品注册收费标准及有关问题的复函》(粤发改价格函〔2017〕460号),广东省局于2017年2月28日发布了《广东省药品、医疗器械产品注册收费有关事项说明》,广东省第二类医疗器械产品的首次注册费81800元,变更注册费34200元,延续注册费34000元,自2017年3月1日起实施。
从表4及图5的数据可以看出,随着医疗器械新法规以及配套规范性文件的落地实施,强调实施医疗器械全生命周期监管,医疗器械生产企业从产品设计开发到产品上市流通过程更加谨慎,特别对于重复设计的产品尤为突出;同时随着医疗器械注册收费政策实施,医疗器械生产企业谨慎申报,受此影响,2017年医疗器械产品注册申请受理数量骤降30.98%。医疗器械注册收费政策的实施,一定程度上减少产品重复申报,也为产业升级创造条件。
2、审评情况
医疗器械产品注册代办2017年广东省局审评认证中心医疗器械审评认证科共办结医疗器械产品注册技术审评3146项,同比增长22.56%,其中,首次注册880项,延续注册661项,许可事项变更注册397项,体外诊断试剂1208项,同比增长27.56%。表5 2016年和2017年广东省医疗器械产品注册技术审评办结情况
| 年份 | 医疗器械(有源和无源类) |
体外诊断 试剂(办结数量) |
|||
|
办结总量 (项) |
首次注册 (项) |
延续注册 (项) |
许可事项变更注册(项) | ||
| 2016年 | 2567 | 814 | 469 | 306 | 947 |
| 2017年 | 3146 | 880 | 661 | 397 | 1208 |
| 同比 | 22.56% | 8.11% | 24.52% | 17.81% | 27.56% |
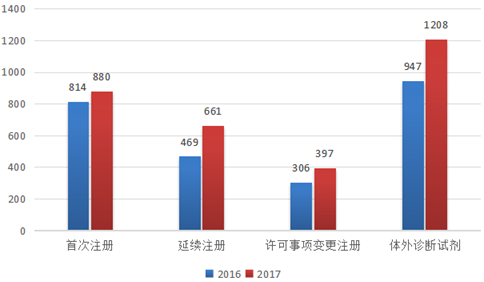
 图6 2016年和2017年广东省医疗器械产品注册技术审评办结情况
图6 2016年和2017年广东省医疗器械产品注册技术审评办结情况3、审批情况
医疗器械产品注册代理据2017年广东省局共批准医疗器械产品注册4058项,同比增长了45.66%,其中,医疗器械(有源和无源类)首次注册704项,延续注册624项,许可事项变更注册329项,登记事项变更注册898项;体外诊断试剂首次注册441项,延续注册290项,许可事项变更注册390项,登记事项变更注册382项。表6 2016年和2017年广东省医疗器械(有源和无源类)产品注册审批情况
| 年份 |
批准总量 (项) |
首次注册 (项) |
延续注册 (项) |
许可事项变更注册(项) | 登记事项变更注册(项) |
| 2016年 | 2555 | 704 | 624 | 329 | 898 |
| 2017年 | 1648 | 571 | 452 | 143 | 482 |
| 同比 | 55.04% | 23.30% | 38.06% | 130.07% | 86.31% |
表7 2016年和2017年广东省体外诊断试剂产品注册审批情况
| 年份 |
批准总量 (项) |
首次注册 (项) |
延续注册 (项) |
许可事项变更注册(项) | 登记事项变更注册(项) |
| 2016年 | 1503 | 441 | 290 | 390 | 382 |
| 2017年 | 1138 | 299 | 282 | 163 | 394 |
| 同比 | 32.08% | 47.50% | 2.76% | 139.27% | -3.05% |
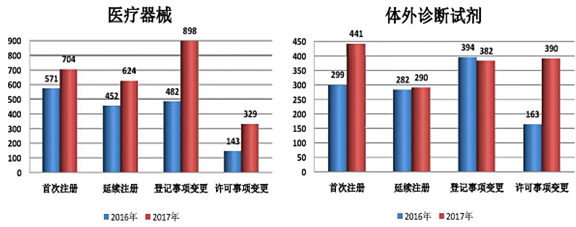

图7 2016年和2017年广东省医疗器械产品注册审批情况
医疗器械注册代理根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发[2015]44号)“提高审评质量,完善集体审评机制”的要求,借鉴总局医疗器械技术审评中心的审评机制改革成效,广东省局行政许可处组织审评中心积极推进审评机制改革,审评质量和效率得到提升,有效的解决2016年以来积压的审评任务。从表5、表6、表7及图6、图7的数据可以看出,2017年省局批准医疗器械产品注册数量同比剧增45.66%,广东省审评审批创新机制初见成效。
随着广州、深圳迈向国际化大都市,企业运营成本逐步攀高,曾经的产业集群配套加工企业陆续向周边迁移,东莞、中山、佛山等地区已经成为医疗器械外迁的主要目的地。
稳定、高效的专业技术人员和研发人员队伍是医疗器械企业保持技术领先优势的重要保障。但随着广州、深圳生活成本增高,专业技术人才开始外流。根据生产企业统计数据显示,自2016年以来广州、深圳医疗器械产业从业人员总数、专业技术人员总数、研发人员数量都有所下降。
另外,深圳土地资源紧缺,医疗器械产业聚集的南山区,由于前海划为自贸区,许多企业租用的厂区到期后无法续租,企业面临迁址问题。坪山区虽然有企业落户政策,但要求较为苛刻,即使落户坪山,也面临研发人员流失困境。此外,处于医疗器械产业链上游的元件、模具加工、材料等企业,以及处于服务环节的医疗器械专用物流等服务企业,因城市改造和产业升级压力,而逐渐搬离,以往完善的深圳医疗器械“一小时供应圈”已出现缺口。
医疗器械注册咨询,医械产业的发展,是一个长期的过程,只有通过不断推出更多科学有效的支持鼓励创新机制,才能真正调动企业研发的积极性。此外,产业的发展还需要配套的公共服务平台,比如医学转化平台,临床试验平台等,为产业发展提供全方位的科技服务,促使医疗器械产业成为更具活力的战略性新兴产业。在这方面,广东部分地区已积极调整其产业扶持政策,如东莞松山湖产业基地、中山国家健康科技产业基地、佛山三水中国医疗器械产业基地等逐步出台长期服务政策,打破了技术、人才和资金上的瓶颈,吸引了更多优质医疗器械生产企业落户,推动医疗器械产业的转型升级。图8、图9中近两年年医疗器械产品注册审批的企业分布和医疗器械产品注册审批的注册证分布正好反映了医疗器械产业转移情况。
深圳鸿远医疗器械咨询服务公司是一家技术专业的医疗器械咨询机构,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服