
医疗器械注册硬性光学内窥镜<有创类>产品的技术要求编写应按照《医疗器械产品技术要求编写指导原则》(国家食品药品监督管理总局通告2014年第9号)编写产品技术要求。示例见本指导原则附1。其中:
1.产品型号/规格及其划分说明
对于注册单元内含有多个型号/规格的情况,应列表说明。此外,建议在此处明确硬性光学内窥镜预期与人体接触部分及其材质。
2.性能指标
应全面引用YY 0068系列标准(YY 0068.1—2008,YY 0068.2—2008,YY 0068.3—2008,YY 0068.4—2009)和产品适用的强制性医疗器械产品注册行业标准;安全部分应全面引用GB 9706.1—2007和GB 9706.19—2000,将内窥镜作为有源设备的应用部分进行测试。电气安全特征部分建议明确应用部分的防电击类型和防进液设备类型。
特别注意,可与高频手术设备配合使用的硬性光学内窥镜应适用GB 9706.19—2000中相应条款,特别是,6.8.2bb)和42.101中相关条款。此外,有以下注意事项:
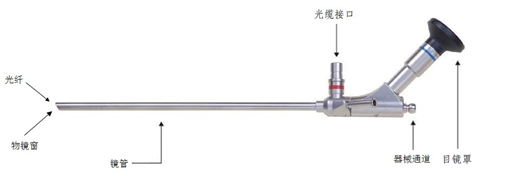
(1)申报产品组成中包含光缆的内窥镜,应对光缆有相应的要求。应引用YY 0763—2009《医用内窥镜 照明用光缆》的要求。同时安全测试也应包含光缆进行。(照明用光缆主要由光导纤维构成,通过接头与内窥镜或者光源连接,作用是传输光)
(2)组成中如包含配合使用的附件,应有相关要求,并对配合使用的性能进行测试。具体的要求和测试指标由产品特性决定。
(3)YY 0068.2—2008中4.4是针对内窥镜插入部分的横截面尺寸过小,或细长比过大容易损坏时或者内窥镜插入部分允许适度弯曲时的要求,其适用性取决于临床的不断反馈,或医疗器械注册申请人自我声明,或资深人员的评价。
(4)YY 0068.4—2009中6电气安全性能与GB 9706.1—2007中相应部分不完全相同,此处特别对目镜罩的绝缘提出要求,应引用并建议列在性能指标部分。(注:目镜罩本身多数采用绝缘材料,在使用中可能与人体的眼周部有接触)
3.检验方法
对于来源于强制性标准中的要求,原则上应采用该标准中的试验方法。如有与产品安全有效性相关的其他要求及由注册申请人自行制定的方法,应针对该试验方法的科学、合理性提交支持性资料。
4.术语(如适用)
医疗器械产品注册硬性光学内窥镜<有创类>产品的注册检验报告
提交具有医疗器械检验资质的医疗器械检验机构出具的检验报告和预评价意见。应提交原件。如选择典型性型号进行检测,应提交典型性声明,从技术角度明确选择典型性型号的依据。
医疗器械注册代办检测报告的产品名称、型号、生产商等基本信息应与申报一致。应明确检测依据和结论。性能部分应与技术要求中性能部分的要求表述一致,安全部分应全面引用相关强制性标准,依据产品的适用性出具完整报告。检测报告的照片页应反映出产品结构组成、基本外观信息、铭牌信息、重点结构和标识。
对于检测中典型性型号选择的问题,原则上可选择同一注册单元里视场角、视向角较大的,工作长度较长的,相对较细的产品;应选择结构复杂的,特别是光学系统较复杂,容易出现薄弱环节的产品。原因是基于以下例举因素的考量:如视场角较大应注意视场边缘的成像质量;视向角比较大的情况需要验证其成像效果;细长比较大的情况对工艺的要求较高,需要验证其光学和机械性能;有特殊结构设置的产品,如可变视向角的内窥镜,需要对其特殊功能进行验证等。
医疗器械产品注册代办在典型性声明中,说明选择型号的原因和依据。总之,所选产品应能代表全部申报产品的安全、有效性。
深圳鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询机构,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服