
医疗器械注册证申请综述资料依据总局关于发布眼科飞秒激光治疗机注册技术审查指导原则的通告(2018年第53号),为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家食品药品监督管理总局组织制定了《眼科飞秒激光治疗机注册技术审查指导原则》,现予发布。根据附件《眼科飞秒激光治疗机注册技术审查指导原则》眼科飞秒激光治疗机注册综述资料要求分为四大项,具体内容如下:
(一)医疗器械产品注册证代办综述资料对产品描述的要求:
1.根据产品自身结构特点阐述各关键组件的工作原理。例如,飞秒激光发生的原理、光束传输及控制的原理。明确飞秒激光的激光物质、激光放大方式。描述患者接口组件的固定方式及原因。OCT或者生物测量组件的工作原理。可结合光路图和/或结构图进行说明。
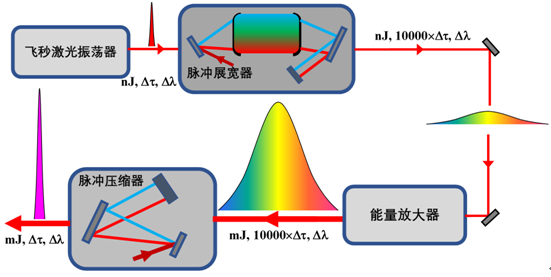
产品工作原理可根据产品实际研发情况进行描述,例如:飞秒激光是指脉冲宽度为10-15秒量级的激光脉冲,由于激光脉冲持续的时间非常短,与生物组织相互作用时几乎没有热效应破坏组织结构,可以实现非常精准细微的切割。眼科手术的飞秒激光一般需要高重复频率如几百kHz,平均功率为瓦量级,脉冲宽度为百飞秒量级的激光参数,要获得这种参数的飞秒激光首先需要一个飞秒种子光源。飞秒种子光源是由飞秒振荡器通过锁模实现的,根据不同增益晶体采用不同的锁模方式,比较常见的有Kerr透镜锁模,SESAM可饱和介质锁模,非线性偏振态变化锁模等。飞秒种子源的能量都非常低,必须将飞秒种子源进行放大后才能使用,飞秒激光的放大方式是以啁啾脉冲放大技术(Chirped -Pulse Amplification,简称CPA)为基础,其工作原理是:首先由振荡器产生稳定的锁模脉冲序列,随后通过脉冲展宽器,在尽可能维持光谱成分不变的情况下,使种子脉冲展宽到数百皮秒使其峰值功率大幅度降低,这样当展宽后的脉冲进入放大器放大时,可以有效地降低种子脉冲的增益饱和效应并避免因过高峰值功率而引起的非线性效应和对材料的损伤,从而保证了能量的稳定增长及高效率放大,最后采用具有与展宽器色散相反的再压缩系统,使脉冲复原到与种子相近的时间宽度,进而得到高峰值功率的飞秒激光脉冲。根据啁啾脉冲放大技术原理,飞秒激光器主要结构包括飞秒脉冲振荡器、脉冲展宽器、能量放大器、脉冲压缩器,以及电子同步选单器等部分。
图1 飞秒激光原理 ,眼科飞秒激光治疗机 医疗器械注册证代办
2.作用机理详述飞秒激光与生物组织(角膜、晶状体前囊膜、晶状体核)相互作用的机理及量效关系。
3.结构组成应详述主机、患者接口组件、OCT或其他生物测量装置(若有)、显示屏、脚踏开关的结构,并提供相应组成部分的图片。详述主机内部的结构,明确飞秒激光器(含冷却系统)、光束传输部件、光束扫描控制部件、辅助光源(如,照明、固视、成像等)的结构。
描述产品的物理尺寸、重量、型号等信息。
对于多种型号规格的产品应列表和/或提供图示说明各型号之间的异同。
提供整机的电路框图,包括激光电源的总体电路框图及各单元模块的电路框图,简述各模块的主要功能及相互关系。
4.描述产品功能及其组成部件(关键组件和软件)的功能。例如,制作角膜瓣、制作角膜切口、晶状体前囊撕开、晶状体核劈碎(对应的关键组件)等。描述OCT等测量装置所能测量的数据类型。描述软件可实现的主要功能,例如,激光扫描方式、制作图形。
5.区别于其他同类产品的特征。描述关键组件及功能与其他同类产品的区别。例如,激光发射的控制方式、角膜瓣结构、激光扫描方式、劈裂晶状体核的方式、照明系统、生物测量装置等。
产品组成示例:
本产品由主机、患者接口组件、OCT、显示屏、脚踏开关、患者床组成。主机包含飞秒激光器、光束传输部件、光束扫描控制部件、辅助光源。
(二)包装说明
提供整机的外包装及内部各组件的包装情况。提供一次性使用无菌手术包与灭菌方法相适应的最初包装的信息。
(三)医疗器械产品注册证申请眼科飞秒激光治疗机产品的适用范围和禁忌症
1.适用范围
应当明确产品在医疗机构使用;明确目标用户及其操作该产品应当具备的技能/知识/培训。
应明确用于屈光手术还是用于白内障手术。明确各种功能所对应的适应症。例如,在白内障手术中制作角膜切口的功能,是用于植入晶体还是用于辅助前囊膜撕开。
适用范围示例:
在医疗机构中由经培训的专业医师使用,用于LASIK手术制作角膜瓣,制作植入物用的囊袋,板层角膜移植。在移除晶状体的白内障手术中,用于前囊膜撕开和晶状体核劈碎。
2.适用人群:目标患者人群的信息,患者选择标准的信息,以及使用过程中需要监测的参数、考虑的因素。例如,目标患者人群为年龄≥18岁的成人。
3.禁忌症
应当按适应症明确说明眼科飞秒激光治疗机不适宜应用的某些疾病、情况或特定的人群。
示例:
进行LASIK手术制作角膜瓣的禁忌症包括:角膜疾病或病理阻碍激光传输,或使激光发生畸变;低眼压或高眼压;青光眼;存在角膜植入物;患者接受后续治疗后预期的残余必要的角膜基质厚度过薄;圆锥角膜。
进行晶状体前囊膜撕开和晶状体核劈碎的禁忌症包括:角膜疾病或病理阻碍激光传输,或使激光发生畸变;角膜结构异常;屈光介质严重混浊;低眼压或高眼压;存在角膜植入物;瞳孔异常。
(四)参考产品
医疗器械产品注册证办理如有申报产品的同类产品和/或前代产品,应说明相关的背景情况,提供同类产品和/或前代产品的上市情况。应当详细说明申报产品与前代产品的异同点,对比主要功能、关键激光参数及完成相应功能的特征参数之间的异同。
深圳鸿远医疗器械咨询服务公司是一家技术专业的医疗器械咨询机构,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械注册证代理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服